El índice de saturación de Langelier
En 1936, el profesor WF Langelier de la Universidad de California, Berkeley, produjo un artículo de investigación . Describió su nuevo método para calcular el pH al que el agua se satura con carbonato de calcio . Este punto de saturación se conoce como pH. El índice de saturación de Langelier (LSI), como se le conoció, expresa la diferencia entre el pH real de una muestra de agua y el pH que tendría si estuviera saturada de carbonato de calcio .
Una lectura de cero sugiere que el agua es agua que tiene una lectura de LSI de cero. Esto significa que no formará cascarilla ni será corrosivo. "class =" glossaryLink "target =" _ self "> equilibrado y no se disolverá ni será probable que lo haga El resultado de una reacción que une dos sustancias disueltas en una solución para formar un sólido insoluble. Como resultado de convertirse en un sólido, el nuevo la sustancia formada 'precipita', es decir, cae al fondo del recipiente. "class =" glossaryLink "target =" _ self "> precipitado cal . Una lectura negativa indica que el agua es agua con la capacidad de disolver carbonato de calcio. El agua insaturada tiene una lectura de LSI por debajo de cero y es probable que sea corrosiva. "class =" glossaryLink "target =" _ self "> insaturada y tiene la capacidad de disolver el carbonato de calcio . Una lectura muy baja como -2 indica que es muy probable que el agua disuelva el carbonato de calcio , y de esto inferimos que el agua probablemente cause corrosión de calderas y tuberías. Una lectura positiva indica que el agua es (Agua) Agua que tiene un exceso de dureza y alcalinidad y dará una lectura de LSI por encima de cero. Es muy probable que esta agua forme incrustaciones de cal. "class =" glossaryLink "target =" _ self "> sobresaturado en carbonato de calcio y será El resultado de una reacción que une dos sustancias disueltas en una solución para formar un sólido insoluble. Como resultado de convertirse en un sólido, la sustancia recién formada "precipita", es decir, cae al fondo del recipiente. "class =" glossaryLink "target =" _ self "> precipitar cal . Una lectura de 2, por ejemplo, indica agua que es propensa a dejar depósitos importantes de cal .
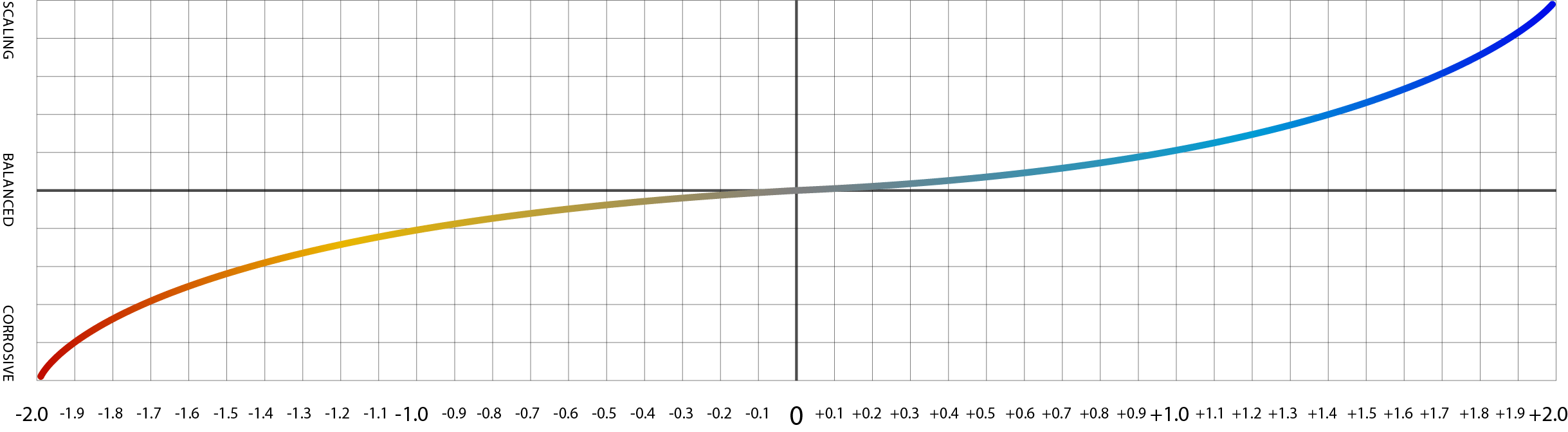
Una imagen de la escala de Langelier donde los números negativos indican corrosividad y los números positivos indican potencial de formación de incrustaciones.
Langelier vio los beneficios de utilizar estratégicamente el potencial de formación de incrustaciones del agua saturada: su idea era utilizar la cal como una especie de revestimiento de teflón. En su artículo de 1936, afirma: " El carbonato de calcio es la sal más útil para formar, o junto con el óxido, ayuda a la formación de una capa protectora natural o autocurativa".
Si tomamos las recomendaciones de Scott Guglielmino (del lesson anterior) como guía, los valores de LSI que oscilan entre 0,2 y 0,7 representan un nivel seguro de saturación de agua que promoverá una formación de cal, pero no excesiva.
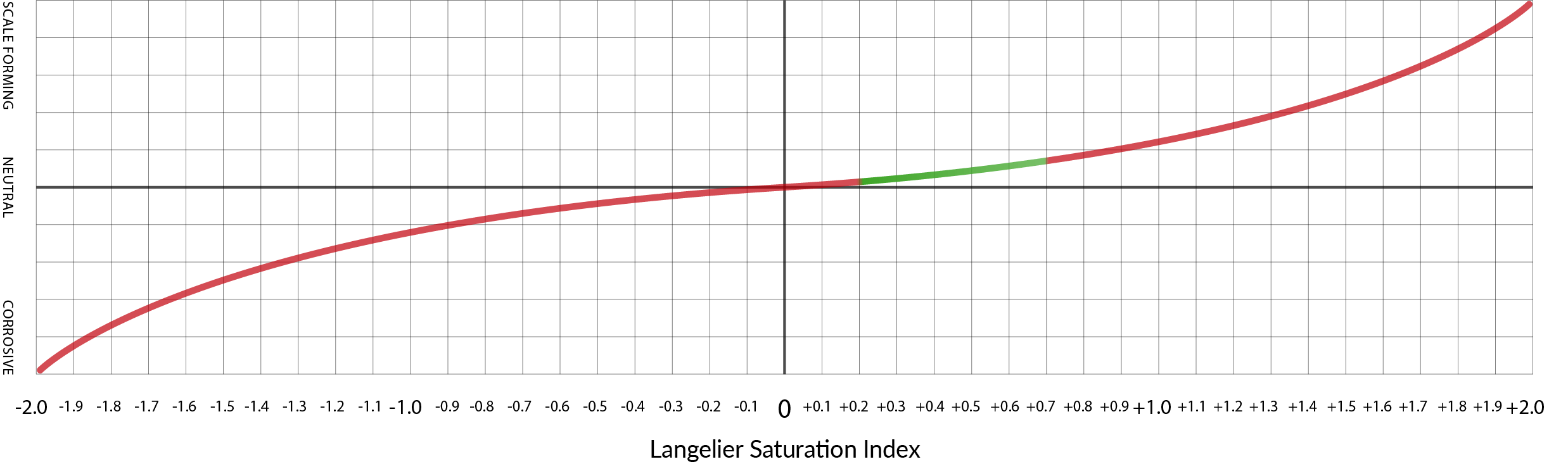
La sección verde de esta ilustración muestra el rango de agua potable de La Marzocco con valores de LSI que van de 0.2 a 0.7