Come funziona l'acqua Sciogliere Sali minerali?
I sali minerali importanti per la preparazione del caffè sono noti come composti ionici e sono tenuti insieme da legami ionici. Non appena questi sali entrano in contatto con l'acqua, iniziano a dissolversi . Quando avviene questa dissoluzione, gli ioni che erano legati insieme come un sale si rompono o si dissociano . Ciò significa che gli ioni che componevano i sali minerali sono ora liberi nell'acqua e non più legati tra loro. Questo succede a tutti i sali minerali quando si dissolvono .
L'acqua non è uno ione, ma si comporta un po' come tale. Poiché l'acqua è una molecola polare , la leggera carica negativa e positiva alle due estremità della molecola è sufficiente per attirare uno ione se ci sono molte molecole d'acqua disponibili per lavorare insieme. Molteplici molecole d' acqua possono avvolgere uno ione, come illustrato di seguito, e tenerlo separato dagli altri ioni.
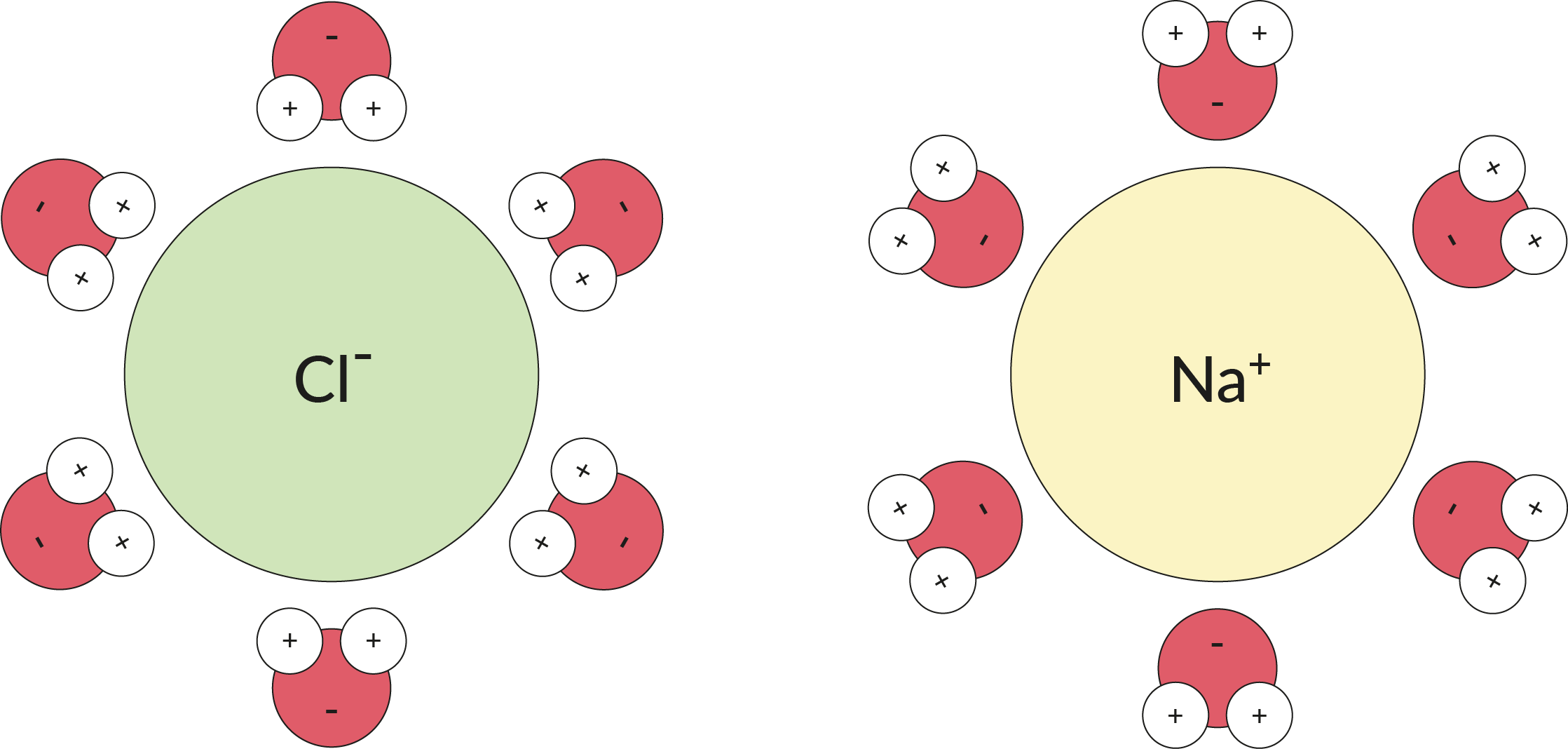
In questa immagine puoi vedere come il sale da cucina, NaCl, può dissociarsi nell'anione cloruro e nel catione sodio dopo che ogni ione è circondato da molecole di H ₂ O .
Rubare elettroni — Legami ionici
I minerali importanti per il caffè assumono tutti la forma di sali minerali. I sali minerali si tengono insieme attraverso il legame ionico . Invece di condividere un elettrone con un altro atomo, un atomo ruba uno o più elettroni da un altro. Questo tipo di connessione è chiamato un legame ionico, e sali minerali sono quindi noti come composti ionici.
Ad esempio, il cloro (Cl), che viene utilizzato per disinfettare l'acqua, ha sette elettroni nel suo guscio esterno. Per diventare stabile, ha bisogno di "rubare" un elettrone da un altro atomo. Quando lo fa, si carica negativamente perché gli elettroni sono caricati negativamente.
Gli atomi che si sono caricati sono noti come ioni. L'atomo che ruba un elettrone acquista una carica negativa e viene chiamato anione.