Quelle est la différence entre une dureté temporaire et permanente et est-ce important pour la préparation du café ?
La dureté est une mesure de la quantité de certains minéraux présents dans l'eau. La quantité et la proportion de minéraux dans votre eau d'infusion peuvent avoir un effet considérable sur la saveur de votre café, ainsi que sur la probabilité que votre machine à expresso soit agrandie. Il vaut donc la peine d'essayer de comprendre quelques concepts clés.
Le terme « dureté » vient à l’origine de l’effet des minéraux présents dans l’eau sur le savon. Les minéraux dans eau dure se lient au savon et forment une « écume » insoluble, ce qui rend plus difficile la formation d'une mousse et rend le savon moins efficace pour le lavage. À un moment donné, les gens ont remarqué que si l’eau était bouillie avant utilisation, l’eau deviendrait moins dure, ce qui faciliterait le lavage. La dureté qui pourrait être éliminée par l'ébullition est appelée dureté temporaire, la dureté qui reste, quelle que soit la quantité de cuisson de l'eau, est appelée dureté permanente.
La définition est donc assez facile à retenir, mais pour vraiment comprendre ce qui se passe, nous devons en savoir un peu plus sur la composition des minéraux présents dans l’eau. Chaque minéral dissous dans l’eau est constitué d’ions, qui sont des particules chargées électriquement. Le minéral solide contient des quantités égales de charges positives et négatives mélangées, de sorte que les charges s’annulent. Par exemple, le sel de table, le chlorure de sodium, est composé à parts égales de sodium chargé positivement (Na+) et des ions chlorure chargés négativement (Cl–). Lorsque le minéral se dissout dans l'eau, les ions se séparent ('dissocier') et étalé dans l'eau.
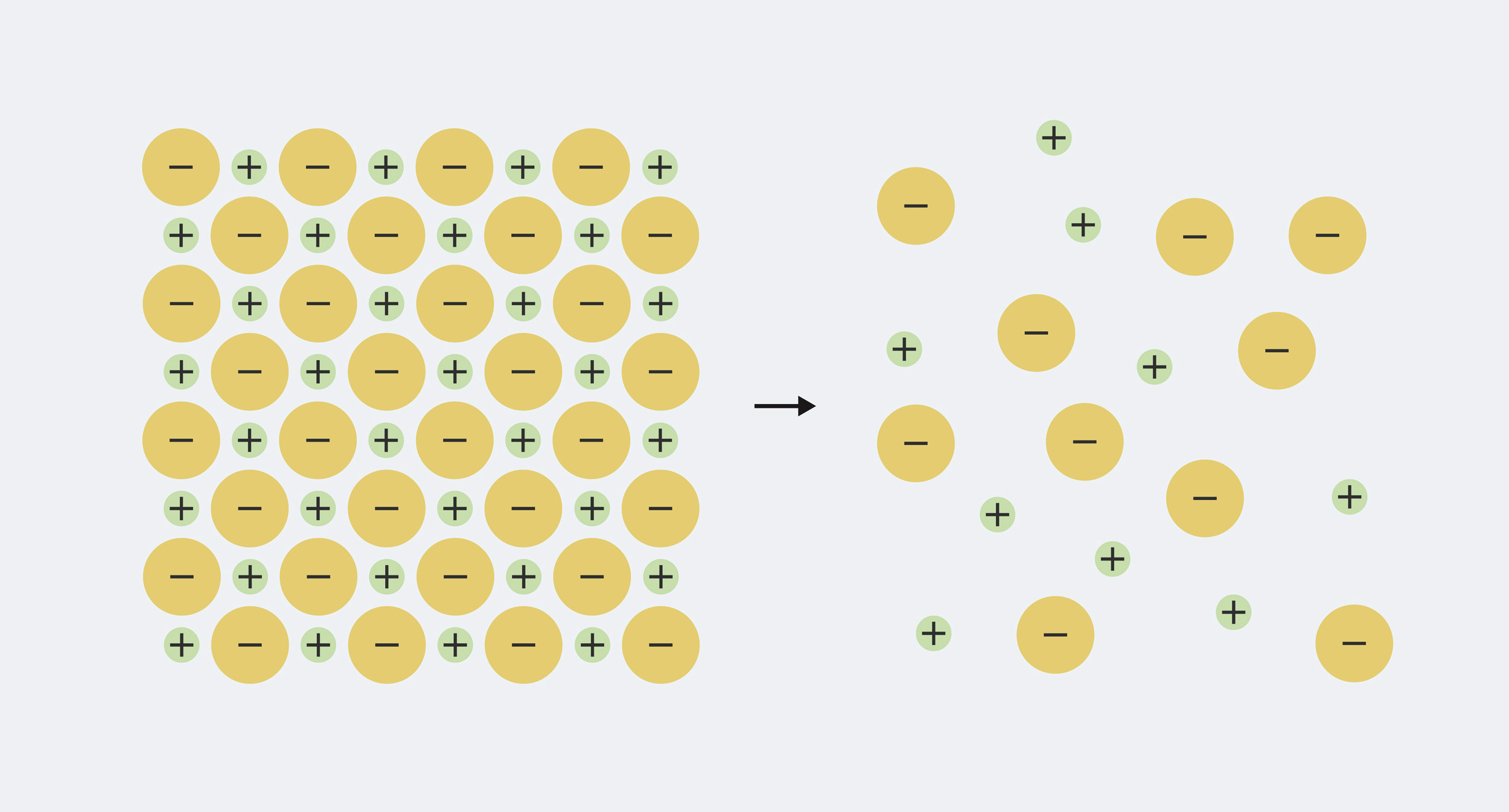 Le sodium et le chlorure contenus dans le sel de table solide sont étroitement emballés. Lorsqu'il est dissous dans l'eau, il se sépare en ions sodium (Na+) et les ions chlorure (Cl–)
Le sodium et le chlorure contenus dans le sel de table solide sont étroitement emballés. Lorsqu'il est dissous dans l'eau, il se sépare en ions sodium (Na+) et les ions chlorure (Cl–)
La dureté est causée par tout minéral dans lequel l'ion chargé positivement a plus d'une charge. La charge la plus forte de ces ions est ce qui les fait interagir avec le savon – et c’est la même charge qui signifie que ces minéraux peuvent aider à extraire les saveurs du café.
Calcium (Ca2+) et le magnésium (Mg2+) constituent la quasi-totalité de la dureté de l’eau potable. Étant donné que le calcium et le magnésium ont tous deux deux charges positives, ils se comportent de manière très similaire et peuvent donc être considérés comme interchangeables lorsque nous parlons de dureté. Certains autres ions, comme le fer (Fe3+) ou en aluminium (Al3+), peut techniquement contribuer (OMS 2011), mais nous les ignorons généralement, car leur quantité dans l’eau potable devrait être très faible.
Ainsi, la dureté totale, également appelée « dureté générale » ou GH, n'est qu'une mesure de la quantité de calcium et de magnésium chargés positivement présente dans l'eau. Parce que la charge électrique de ces ions aide à extraire la saveur molécules, la mesure du GH est un indicateur du pouvoir d'extraction de l'eau.
Rappelez-vous maintenant que chaque ion minéral chargé positivement doit également être associé à des ions chargés négativement. Le plus important d’entre eux dans l’eau est le bicarbonate (HCO3–). Lorsque vous faites bouillir de l'eau contenant du bicarbonate, celui-ci réagit avec le calcium et le magnésium présents dans l'eau pour former un solide appelé calcaire (carbonate de calcium et carbonate de magnésium). C'est donc ce qui cause une dureté temporaire : en faisant bouillir l'eau, vous formez calcaire, qui descend vers le bas. La dureté permanente correspond à la dureté restante : tout calcium ou magnésium qui ne contient pas de bicarbonate avec lequel réagir.
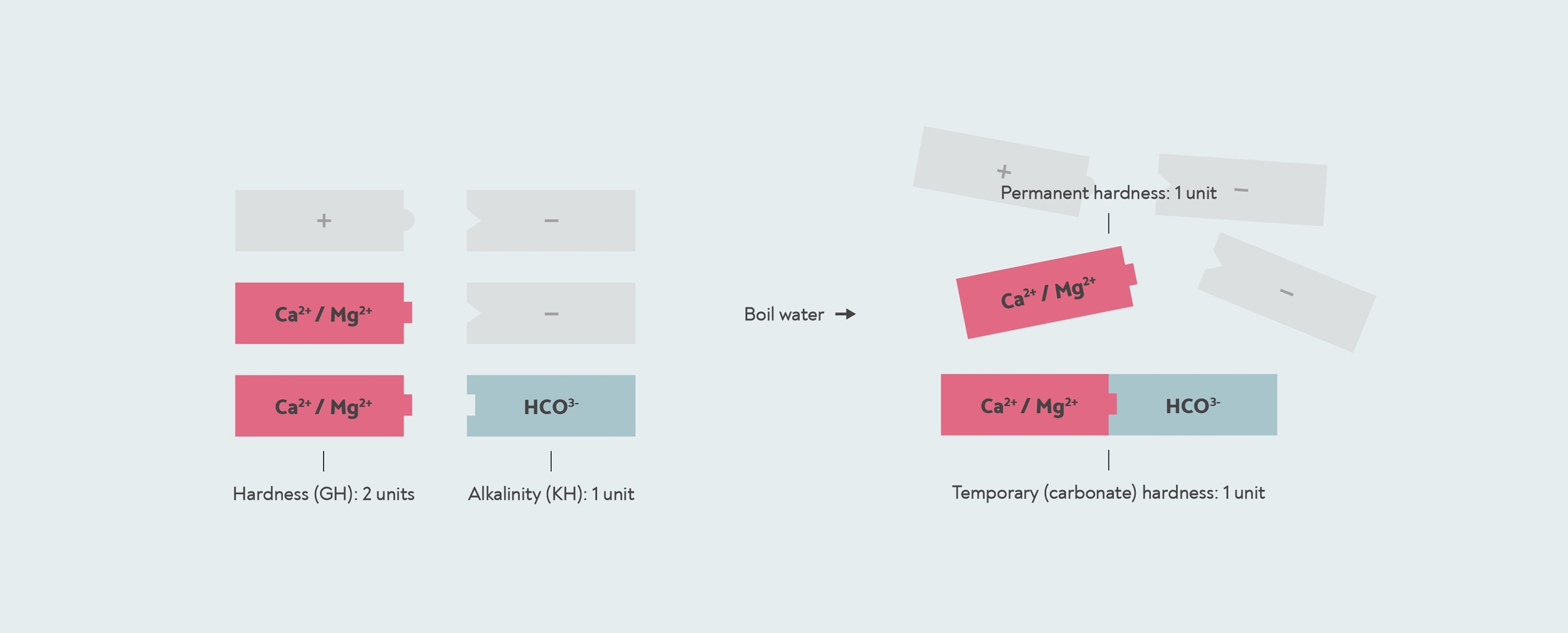 Dureté temporaire et permanente. Cette eau a un GH de 2, car elle contient deux unités calcium/magnésium (rouge). Il a une dureté temporaire de 1, car une unité carbonate se lie à un calcium/magnésium pour former calcaire. L'autre calcium/magnésium est une dureté permanente qui ne se forme pas calcaire et n'est pas éliminé par l'ébullition. Les autres ions minéraux positifs et négatifs présents dans l'eau sont représentés en gris.
Dureté temporaire et permanente. Cette eau a un GH de 2, car elle contient deux unités calcium/magnésium (rouge). Il a une dureté temporaire de 1, car une unité carbonate se lie à un calcium/magnésium pour former calcaire. L'autre calcium/magnésium est une dureté permanente qui ne se forme pas calcaire et n'est pas éliminé par l'ébullition. Les autres ions minéraux positifs et négatifs présents dans l'eau sont représentés en gris.
Lorsque nous mesurons la dureté de notre eau, nous effectuons généralement deux mesures : GH et KH. GH est la dureté générale et mesure la quantité totale de calcium et de magnésium dans l'eau. KH signifie Karbonathärte, qui signifie dureté carbonatée en allemand. La dureté carbonatée est exactement la même que la dureté temporaire : elle désigne toute la dureté qui est associée aux ions bicarbonates, qui peuvent se former calcaire.
Cependant, là où cela devient déroutant, c'est qu'un test KH typique ne mesure pas réellement la dureté carbonatée. Un test de chute KH mesure simplement la quantité de bicarbonates dans l'eau, également appelé alcalinité. Cette mesure est également importante parce que alcalinité tamponne acidité dans le café et lui donne un goût moins aigre. Trop alcalinité donnera au café un goût plat.
Dans notre exemple jusqu'à présent, le alcalinité est exactement la même que la dureté temporaire, car il y a suffisamment de calcium et de magnésium pour réagir avec tout le bicarbonate et former calcaire. C'est le cas de la plupart des eaux potables naturelles — la alcalinité et la dureté carbonatée ou la dureté temporaire sont exactement les mêmes, donc la plupart du temps, le test KH vous indique également la dureté carbonatée.
Cependant, dans certains cas, la quantité de bicarbonate peut être supérieure à la quantité de calcium ou de magnésium. Cela peut se produire lorsque l'eau a été adoucie ou lorsque de l'eau salée s'est infiltrée dans l'eau potable. Dans ce cas, il se peut qu’il n’y ait pas suffisamment de calcium et de magnésium pour réagir avec tout le bicarbonate. Avec ce type d’eau, si vous la faites bouillir, toute la dureté est éliminée, donc la dureté temporaire est la même que la dureté totale, et il n’y a aucune dureté permanente.
Dans ce cas, le test KH vous donnera un résultat supérieur à votre GH. Lorsque le résultat d’un test KH est supérieur au GH, alors la dureté carbonatée et la dureté générale sont en réalité les mêmes. Le nombre que vous donne le test KH est alors en réalité le alcalinité, pas la dureté carbonatée.
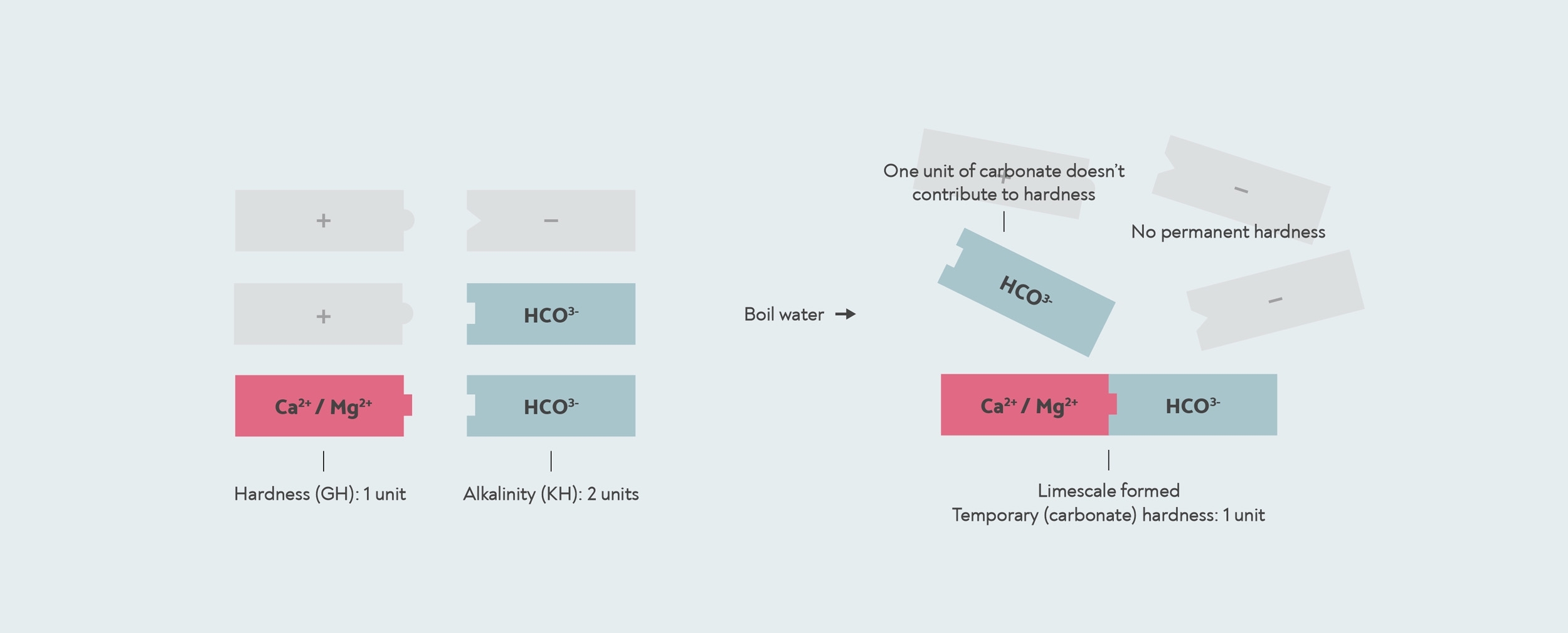 Quand le alcalinité est supérieure à la dureté générale, alors toute la dureté est temporaire ou dureté carbonatée. Dans ce cas, le reste alcalinité ne contribue pas à la dureté. Le kit de chute KH mesure un alcalinité de 2, mais la dureté carbonatée n'est en réalité que de 1, car il n'y a qu'une seule unité de dureté pour qu'elle se forme calcaire avec.
Quand le alcalinité est supérieure à la dureté générale, alors toute la dureté est temporaire ou dureté carbonatée. Dans ce cas, le reste alcalinité ne contribue pas à la dureté. Le kit de chute KH mesure un alcalinité de 2, mais la dureté carbonatée n'est en réalité que de 1, car il n'y a qu'une seule unité de dureté pour qu'elle se forme calcaire avec.
Ce cas est suffisamment rare dans l’eau du robinet pour que la plupart d’entre nous puissent l’ignorer lorsque nous testons notre eau. Dans la plupart des eaux potables, KH = alcalinité = dureté temporaire. La dureté permanente correspond à la dureté restante, donc : Dureté permanente = GH − KH.
En résumé, voici les trois mesures qui comptent vraiment dans la préparation du café : la dureté totale ou dureté générale (GH), la dureté temporaire, ou dureté carbonatée, et la alcalinité. La dureté totale aide l'eau à extraire la saveur du café. La dureté temporaire est ce qui détermine la quantité de dureté qui peut se former. calcaire. Finalement, le alcalinité détermine la quantité d'eau qui sera éliminée acidité du café.
Si le KH est inférieur à GH, alors le test KH vous donne le chiffre à la fois de la dureté temporaire et de la alcalinité, parce que KH détermine la quantité de GH qui peut se former calcaire. Si le KH est supérieur à GH, alors le KH mesure simplement le alcalinité, et la dureté temporaire est la même que la dureté totale, car le KH « supplémentaire » ne peut pas se former calcaire par lui-même.





Sur la base de l'explication, je suis perplexe quant à la raison pour laquelle il y a cette clause de non-responsabilité sur l'utilisation des recettes d'eau – « NB : si vous préparez votre propre eau avec des sels de magnésium (tels que les sels d'Epsom), le calcul LSI ne s'applique pas car non. le calcium est présent. Nous déconseillons d’utiliser ce type d’eau dans les machines à expresso. –
Cette page mentionne que le magnésium se liera aux carbonates présents, ce qui se traduira par KH (dureté temporaire). Cela entraînera une légère formation de tartre et c'est une bonne chose, selon l'une des réponses ci-dessus, cela crée un bon cycle dans lequel une fine couche de calcaire protecteur se forme sur la chaudière qui échange continuellement avec la nouvelle eau reminéralisée ajoutée au fur et à mesure. l'eau bout et refroidit.
Mon objectif est de créer une eau qui a bon goût mais qui peut également être utilisée en toute sécurité dans une machine à expresso. Puis-je utiliser les recettes de cette URL en toute sécurité ? https://www.baristahustle.com/app-archive-main/the-water-calculator/
Salut Samizzle. Le fait est que si vous créez une eau de café en utilisant de l'eau distillée qui ne contient aucun calcium, même après y avoir ajouté vos sels d'Epsom et votre bicarbe via les concentrés que nous recommandons ici https://www.baristahustle.com/blog/diy-water-recipes-redux/, il est possible que cette eau ne forme toujours pas de tartre et puisse également faire rouiller des parties de votre chaudière ou d'autres composants. C'est pourquoi nous avons créé le calculateur de bouteilles, pour vous permettre de reminéraliser une eau contenant une quantité connue de calcium dans un premier temps. Avec le course, vous devez faire attention à ne pas vous retrouver avec une eau trop calcaire, donc même si vous trouvez une bonne eau de base qui pourrait contenir, disons, 30 milligrammes/L de calcium selon l'étiquette sur la bouteille, assurez-vous pour tester sa GH aussi.
Intéressant, je découvre qu'au moment où je pensais avoir compris ça, je ne comprends rien du tout :S. J'essaie encore de comprendre la différence entre le magnésium et le calcium par rapport à la production de calcaire étant donné cette affirmation : « Puisque le calcium et le magnésium ont tous deux deux charges positives, ils se comportent de manière très similaire, ils peuvent donc être considérés comme interchangeables lorsque nous parlons de dureté.
Êtes-vous en train de dire que le carbonate de calcium dépose du calcaire plus facilement que le carbonate de magnésium ? Si oui, est-il possible de suggérer quelle quantité de calcium je pourrais ajouter dans mon 1 L de concentré de dureté (en plus des 2,45 g de sels d'Epsom que j'ai déjà ajoutés) pour équilibrer cela correctement et éviter la corrosion ?
C'est correct. Le magnésium peut former une sorte de tartre, mais il n'a pas tendance à adhérer aux surfaces de la même manière que le calcaire (le calcaire est du calcium par définition).
Le potentiel de formation de tartre de votre eau (tel que mesuré par LSI) ne dépend pas seulement de la quantité de Ca : il dépend également des autres éléments présents, du pH de l'eau et même de la température. Je ne peux donc pas vous donner de recommandation précise, mais vous encourage à vérifier le LSI de votre eau auprès de notre Calculateur d'eau.
Cela dit, le fait que la corrosion constitue ou non un risque sérieux pour votre machine dépend de sa composition et de la manière dont elle est construite. De nombreuses machines fonctionnent avec de l’eau distillée sans problème pendant de nombreuses années, d’autres peuvent subir de la corrosion même avec de l’eau naturelle. Pour un peu plus d'informations à ce sujet, consultez l'AMA que nous avons fait sur l'eau.
Excellentes informations, merci. J'ai une autre question pour vous. Notre eau est relativement dure, entre 350 et 400 ppm. Nous sommes en train de sélectionner soit un adoucisseur d'eau pour extraire les ions minéraux, soit un conditionneur d'eau TAC pour forcer les ions à cristalliser mais ne les élimine pas. Comment la présence de ces cristaux inertes affecterait-elle le breuvage ?
Salut Dan, merci pour ton commentaire. Nous n'avons pas d'expérience directe avec le TAC ou les options de traitement de l'eau associées (telles que les conditionneurs d'eau magnétiques ou électriques), mais nous sommes sceptiques.
La façon dont ce type de conditionneur d’eau fonctionnerait est de forcer la formation de microcristaux de carbonate de calcium – en d’autres termes, de minuscules cristaux de calcaire. La théorie est qu’en formant des cristaux dans l’eau, vous l’empêchez de se former sur la surface métallique de votre chauffe-eau.
Il est possible que le TAC puisse aider à réduire la formation de calcaire dans certaines situations, mais son efficacité dans la plupart des contextes réels est loin d'être prouvée. Cette page a un bon aperçu de ce que l'on sait peu à leur sujet et souligne un défaut majeur : les cristaux ne se formeront que si l'eau est sursaturée. Ainsi, même si cela peut fonctionner jusqu'à un certain point, il peut ne pas être aussi efficace qu'un adoucisseur pour obtenir aux niveaux de dureté que nous aimons pour le café.
Comme ils le citent : « Cela ne peut rien faire pour empêcher le dépôt de tartre sur des surfaces à plus haute température où les carbonates seront moins solubles, ni pour éliminer les ions de dureté jusqu'à un niveau auquel ils ne formeront pas d'écume avec le savon. » Je soupçonne que si l'eau est encore suffisamment dure pour former une écume de savon, elle est suffisamment dure pour avoir un effet négatif sur le café. Il convient également de garder à l'esprit que ces cristaux ne sont pas « inertes » : ce sont simplement de petits cristaux de calcaire et rien n'empêche leur redissolution dans l'eau.
Si vous – ou l’un de nos lecteurs – essayez un conditionneur TAC pour leur café, nous serions ravis de connaître votre expérience. Mais pour l’instant, nous vous recommandons de vous en tenir aux adoucisseurs ou aux unités RO pour être sûr d’obtenir de bons résultats.
Je trouve toujours que l’eau est la partie la plus déroutante et la plus complexe du café. Question : si la plupart de l'eau du robinet a un niveau de HCO- inférieur à celui de Mg+ et Ca+, et que lorsque l'eau est bouillie, tous les HCO- « s'associent » avec Mg+ et Ca+ (formant du calcaire), comment peut-il rester du HCO- dans l'eau du robinet ? de l'eau pour réduire son acidité ?
j'ai la même question que toi. je cherche une réponse de BH
Salut Will – il y a deux choses en jeu ici.
La première est que le calcaire met du temps à se former. Si vous faites bouillir une bouilloire pour le café, seule une petite quantité de calcaire se formera au moment où vous préparez votre café, il y aura donc encore beaucoup de bicarbonate dans l'eau après l'ébullition. Vous devrez faire bouillir votre bouilloire pendant un long moment pour éliminer tout le calcaire.
Désormais, dans une machine à expresso, la bouilloire bout effectivement pendant longtemps – pour toujours, si vous ne l'éteignez pas. Mais dans ce cas, le deuxième facteur entre en jeu : le calcaire présent dans la chaudière commence également à se dissoudre dans l’eau. Il existe un point d'équilibre où la quantité de calcaire dissoute est la même que la quantité formée – c'est l'idée derrière l'indice de saturation de Langelier, sur lequel vous pouvez en savoir plus dans Le Cours d'Eau.
Ah merci, cela a beaucoup de sens. Ainsi, en maintenant l'eau à haute température dans un récipient « propre » pendant une longue période, vous pourriez perdre plus de bicarbe, mais la filtration devient évidemment une option plus judicieuse.
Hé! J'ai longtemps été intrigué par une question simple : si Mg forme une échelle aussi bien que Ca, pourquoi Hendon et M CD préconisent de remplacer Ca par Mg ? Ou est-ce que Mg est en quelque sorte « plus sûr » en termes de mise à l’échelle (étant donné que les sources 95% ne mettent en garde que contre Ca, cela semble certainement le cas…) ?
Bonjour, merci d'avoir posté ceci – c'est une bonne question.
La réponse courte est qu’ils pensent que cela améliore la saveur. Ils proposent que Mg extrait proportionnellement davantage de composés aromatiques souhaitables. Ceci est basé sur leurs propres tests de goût, et ils suggèrent un mécanisme via la chimie computationnelle (https://pubs.acs.org/doi/pdf/10.1021/jf501687c) mais à ma connaissance, cela n'a pas été confirmé de manière indépendante.
La principale raison pour laquelle la plupart des sources mettent en garde contre le tartre de calcium est que le calcium est généralement le principal composant de la dureté de l'eau potable, donc le tartre de magnésium ne pose pas vraiment de problème. Cependant, remplacer le calcium par du magnésium peut également réduire légèrement l’impact du tartre. Le magnésium interfère avec la structure cristalline du tartre de carbonate de calcium, ce qui le rend plus susceptible de former des cristaux d'aragonite, qui sont légèrement plus solubles que les cristaux de calcite formés par du carbonate de calcium pur. Le magnésium lui-même forme des écailles de carbonate de magnésium et d'hydroxyde de magnésium, mais ces deux éléments sont un peu plus solubles que l'hydroxyde de calcium à 100 °C. Il semble donc possible qu’avoir une proportion plus élevée de magnésium soit également « plus sûr ».
Ouais, merci pour la réponse, c'est vraiment utile ! C'est quelque chose que je n'ai pas encore rencontré.
« … mais les deux sont un peu plus solubles que l'hydroxyde de calcium à 100 °C » – vous voulez dire CaCO3 ici, n'est-ce pas ?
J'habite aux États-Unis et d'après ce que je peux comprendre du rapport sur la qualité de l'eau de mon district local des eaux, nous avons de l'eau très dure. J'utilise donc de l'eau en bouteille pour faire du café. Je suis tombé sur le pichet d'eau Peak. Je me demandais si vous aviez tous eu l'occasion de le vérifier.
Salut Timothée. Le filtre Peak Water est très bien évalué. Scott Rao le recommandait vivement dans son récent bulletin d'information de décembre. Un commentaire que nous avons entendu à plusieurs reprises est que la cohérence est moins constante dans le temps, mais cela est normal avec tous les systèmes échangeurs d'ions.
J'ai comparé Peak avec la carafe filtrante Brita Marella (utilisant des cartouches Maxtra). Ils sont tous les deux presque aussi efficaces en termes d'échange d'ions (la cartouche Brita a été un peu utilisée, j'ai donc fait une remise pour cela), mais le TBH Brita semble beaucoup plus solide en termes de matériaux et de design. Peak a malheureusement cette sensation de plastique de fabrication chinoise de mauvaise qualité, et j'ai peur que cela ne dure pas longtemps.