Qual è la differenza tra durezza temporanea e permanente e ha importanza per la preparazione del caffè?
La durezza è una misura della quantità di alcuni minerali nell'acqua. La quantità e la proporzione di minerali nell'acqua di preparazione possono avere un effetto drammatico sul sapore del tuo caffè, oltre a influenzare la probabilità che la tua macchina per caffè espresso si ingrandisca, quindi vale la pena provare a capire alcuni concetti chiave.
Il termine "durezza" deriva originariamente dall'effetto dei minerali nell'acqua sul sapone. I minerali in acqua dura si legano al sapone e formano una "schiuma" insolubile, rendendo più difficile la formazione di schiuma e rendendo il sapone meno efficace nel lavaggio. Ad un certo punto, le persone hanno notato che se l'acqua veniva bollita prima dell'uso, l'acqua diventava meno dura, facilitando il lavaggio. La durezza che potrebbe essere rimossa con l'ebollizione è indicata come durezza temporanea, la durezza che rimane, non importa quanto si fa bollire l'acqua, è chiamata durezza permanente.
Quindi la definizione è abbastanza facile da ricordare, ma per capire veramente cosa sta succedendo, abbiamo bisogno di sapere un po' di cosa sono fatti i minerali nell'acqua. Ogni minerale che si dissolve nell'acqua è costituito da ioni, che sono particelle caricate elettricamente. Il minerale solido ha uguali quantità di carica positiva e negativa mescolate insieme, quindi le cariche si annullano a vicenda. Ad esempio, il sale da cucina, il cloruro di sodio, è costituito da parti uguali di sodio caricato positivamente (Na+) e ioni cloruro a carica negativa (Cl–). Quando il minerale si dissolve in acqua, gli ioni si dividono ('dissociarsi') e disteso nell'acqua.
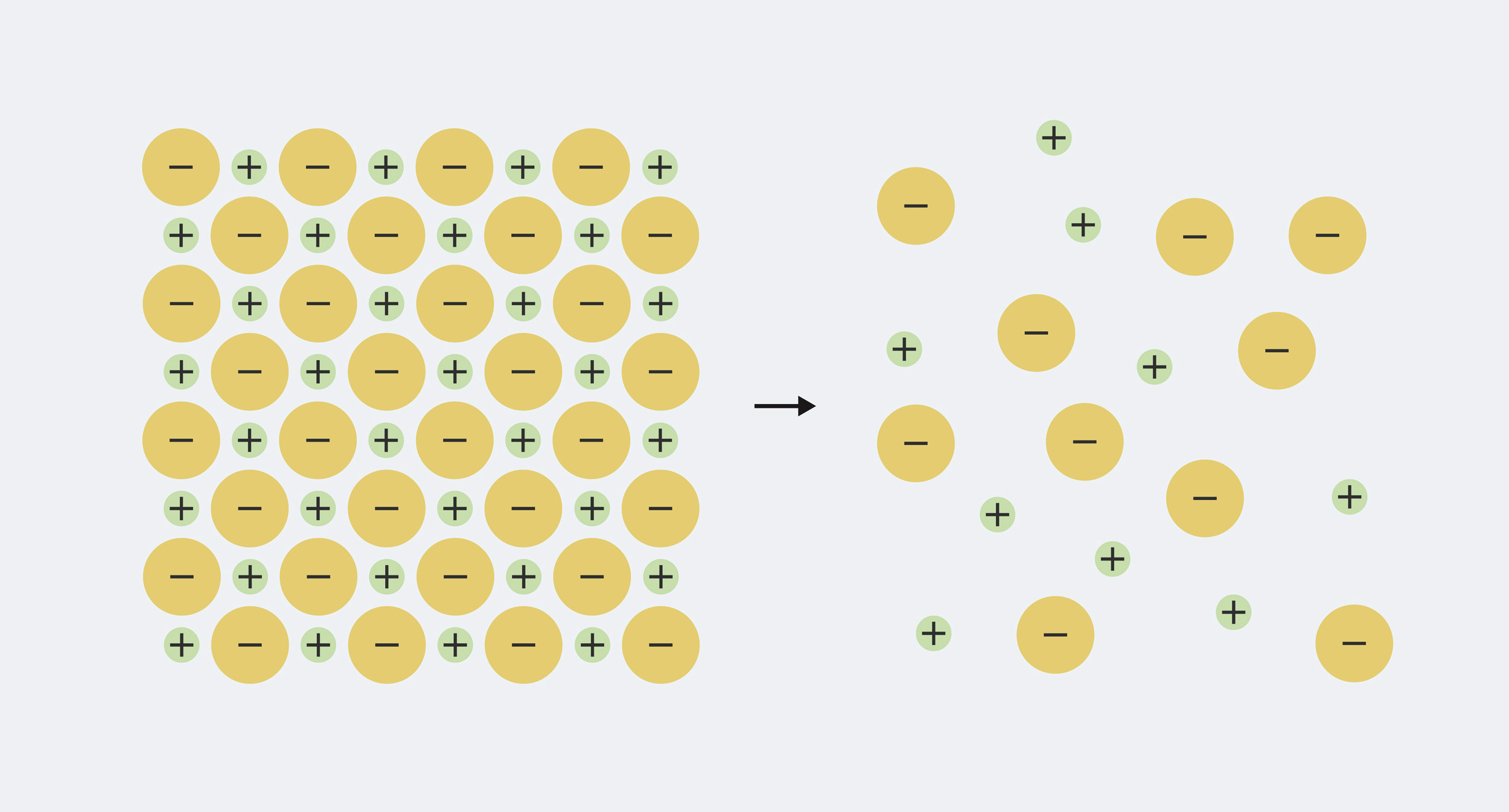 Il sodio e il cloruro nel sale da tavola solido sono confezionati strettamente insieme. Quando si scioglie in acqua, si separa in ioni sodio (Na+) e ioni cloruro (Cl–)
Il sodio e il cloruro nel sale da tavola solido sono confezionati strettamente insieme. Quando si scioglie in acqua, si separa in ioni sodio (Na+) e ioni cloruro (Cl–)
La durezza è causata da qualsiasi minerale in cui lo ione caricato positivamente ha più di una carica. La carica più forte in questi ioni è ciò che lo fa interagire con il sapone - ed è la stessa carica che significa che questi minerali possono aiutare a estrarre i sapori dal caffè.
Calcio (Ca2+) e Magnesio (Mg2+) costituiscono quasi tutta la durezza dell'acqua potabile. Poiché calcio e magnesio hanno entrambi due cariche positive, si comportano in modo molto simile, quindi possono essere considerati intercambiabili quando si parla di durezza. Alcuni altri ioni, come il ferro (Fe3+) o alluminio (Al3+), può tecnicamente contribuire (CHI 2011), ma normalmente li ignoriamo, poiché la loro quantità nell'acqua potabile dovrebbe essere molto bassa.
Quindi la durezza totale, chiamata anche "durezza generale" o GH, è solo una misura della quantità di calcio e magnesio caricati positivamente che si trova nell'acqua. Perché la carica elettrica in questi ioni aiuta ad estrarre il sapore molecole, la misura del GH è un indicatore del potere di estrazione dell'acqua.
Ora ricorda che ogni ione minerale caricato positivamente deve essere accoppiato anche con ioni caricati negativamente. Il più importante di questi in acqua è il bicarbonato (HCO3–). Quando fai bollire l'acqua con il bicarbonato, reagisce con qualsiasi calcio e magnesio nell'acqua per formare un solido chiamato calcare (carbonato di calcio e carbonato di magnesio). Quindi questo è ciò che provoca la durezza temporanea: facendo bollire l'acqua, ti stai formando calcare, che scende verso il basso. La durezza permanente è qualunque sia la durezza residua, qualsiasi calcio o magnesio che non ha bicarbonato con cui reagire.
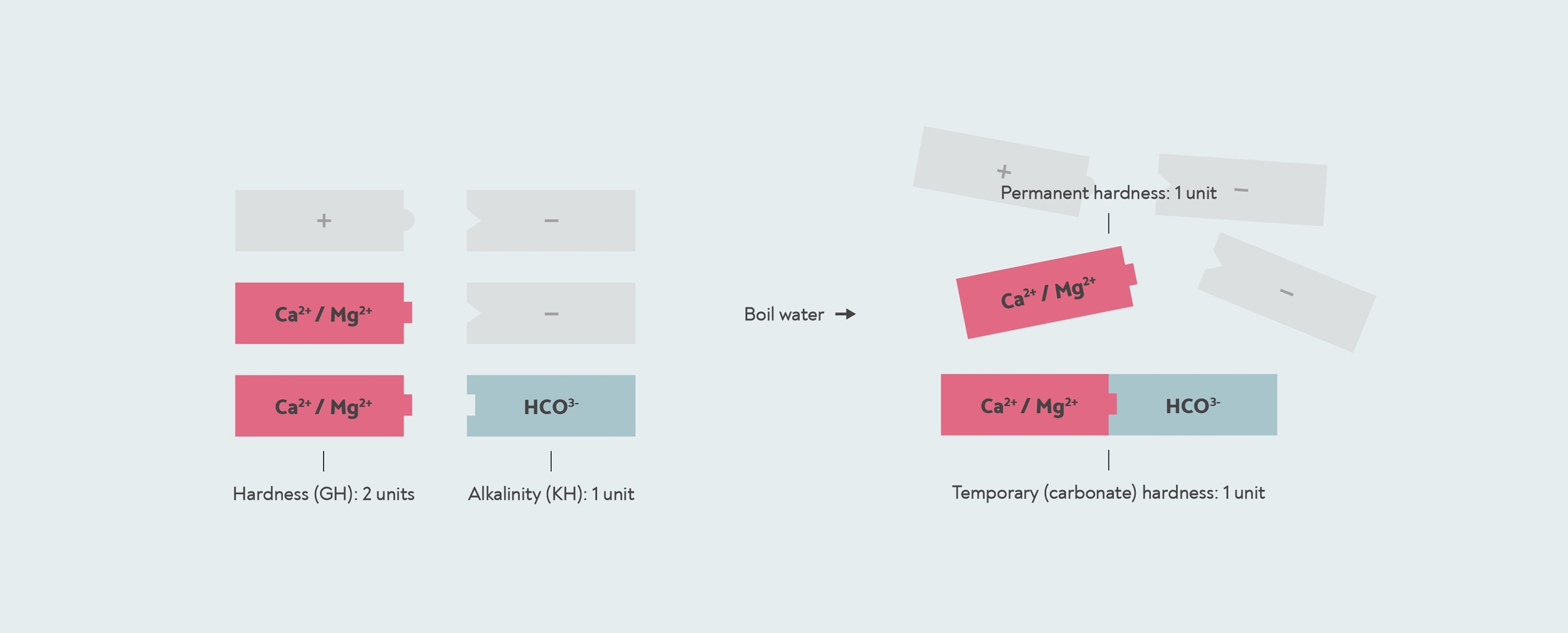 Durezza temporanea e permanente. Quest'acqua ha un GH di 2, perché contiene due unità di calcio/magnesio (rosse). Ha una durezza temporanea di 1, perché un'unità di carbonato si lega a un calcio/magnesio per formare calcare. L'altro calcio/magnesio è la durezza permanente che non si forma calcare e non viene rimosso dall'ebollizione. Gli altri ioni minerali positivi e negativi nell'acqua sono mostrati in grigio.
Durezza temporanea e permanente. Quest'acqua ha un GH di 2, perché contiene due unità di calcio/magnesio (rosse). Ha una durezza temporanea di 1, perché un'unità di carbonato si lega a un calcio/magnesio per formare calcare. L'altro calcio/magnesio è la durezza permanente che non si forma calcare e non viene rimosso dall'ebollizione. Gli altri ioni minerali positivi e negativi nell'acqua sono mostrati in grigio.
Quando misuriamo la durezza della nostra acqua, di solito facciamo due misurazioni: GH e KH. GH è la durezza generale e misura la quantità totale di calcio e magnesio nell'acqua. KH sta per Karbonathärte, che in tedesco significa durezza carbonatica. La durezza carbonatica è esattamente la stessa della durezza temporanea: significa tutta la durezza che è accoppiata agli ioni bicarbonato, che possono formare calcare.
Tuttavia, dove si crea confusione è che un tipico test KH in realtà non misura la durezza carbonatica. Un test di caduta KH misura semplicemente la quantità di bicarbonati nell'acqua, chiamata anche alcalinità. Questa misura è importante anche perché il alcalinità respinge acidità nel caffè e lo rende meno aspro. Troppo alcalinità renderà il caffè un sapore piatto.
Nel nostro esempio finora, il alcalinità è esattamente la stessa della durezza temporanea, perché c'è abbastanza calcio e magnesio per reagire con tutto il bicarbonato e formare calcare. Questo è il caso della maggior parte dell'acqua potabile naturale - il alcalinità e la durezza carbonatica o la durezza temporanea sono esattamente le stesse, quindi la maggior parte delle volte il test KH ti dice anche la durezza carbonatica.
Tuttavia, in alcuni casi, la quantità di bicarbonato può essere superiore alla quantità di calcio o magnesio. Ciò può accadere quando l'acqua è stata addolcita o quando l'acqua salata è entrata nell'acqua potabile. In questo caso, potrebbe non esserci abbastanza calcio e magnesio per reagire con tutto il bicarbonato. Con questo tipo di acqua, se la fai bollire, tutta la durezza viene rimossa, quindi la durezza temporanea è uguale alla durezza totale e non c'è affatto durezza permanente.
In questo caso, il test KH ti darà un risultato più alto del tuo GH. Quando il risultato di un test KH è superiore al GH, la durezza carbonatica e la durezza generale sono effettivamente le stesse. Il numero che ti dà il test KH è quindi in realtà il alcalinità, non la durezza carbonatica.
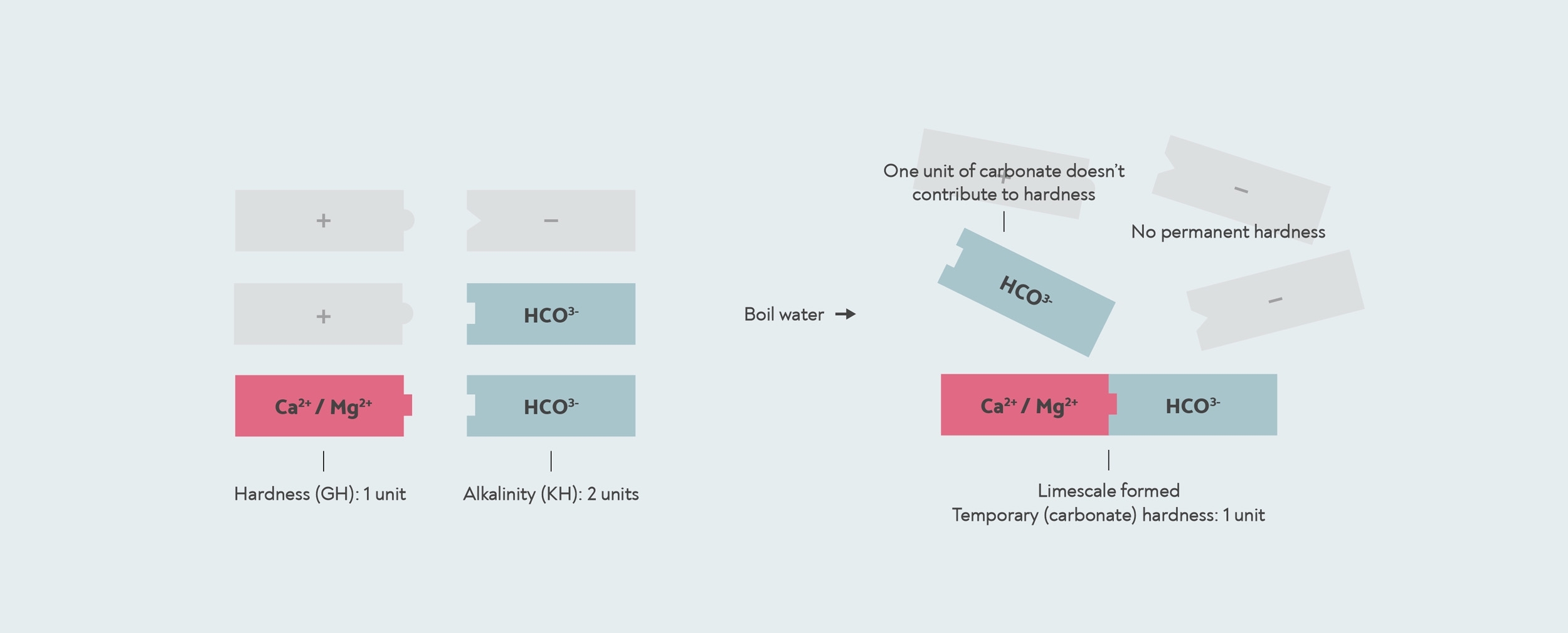 Quando il alcalinità è superiore alla durezza generale, quindi tutta la durezza è temporanea o durezza carbonatica. In questo caso, il restante alcalinità non contribuisce alla durezza. Il kit di caduta KH misura an alcalinità di 2, ma la durezza carbonatica è in realtà solo 1, perché c'è solo 1 unità di durezza da formare calcare insieme a.
Quando il alcalinità è superiore alla durezza generale, quindi tutta la durezza è temporanea o durezza carbonatica. In questo caso, il restante alcalinità non contribuisce alla durezza. Il kit di caduta KH misura an alcalinità di 2, ma la durezza carbonatica è in realtà solo 1, perché c'è solo 1 unità di durezza da formare calcare insieme a.
Questo caso è abbastanza raro nell'acqua del rubinetto, tuttavia, che la maggior parte di noi può ignorarlo quando testiamo la nostra acqua. Nella maggior parte dell'acqua potabile, KH = alcalinità = durezza temporanea. La durezza permanente è qualunque sia la durezza residua, quindi: Durezza permanente = GH − KH.
In sintesi, queste sono le tre misure che contano davvero nella preparazione del caffè: la durezza totale o durezza generale (GH), la durezza temporanea, o durezza carbonatica, e la alcalinità. La durezza totale aiuta l'acqua ad estrarre il sapore dal caffè. La durezza temporanea è ciò che determina quanto di quella durezza può formarsi calcare. Infine, il alcalinità determina quanto l'acqua rimuoverà acidità dal caffè.
Se il KH è inferiore a GH, il test KH fornisce la cifra sia per la durezza temporanea che per il alcalinità, perché KH determina quanto del GH può formarsi calcare. Tuttavia, se il KH è superiore a GH, il KH misura solo il alcalinità, e la durezza temporanea è uguale alla durezza totale, perché il KH "extra" non può formarsi calcare da solo.





Sulla base della spiegazione, sono perplesso sul motivo per cui c'è questa esclusione di responsabilità sull'uso delle ricette dell'acqua – “NB: Se stai producendo la tua acqua con sali di magnesio (come i sali di Epsom), il calcolo LSI non si applica poiché non il calcio è presente. Sconsigliamo l’uso di questo tipo di acqua nelle macchine per caffè espresso.” –
Questa pagina menziona che il magnesio si lega ai carbonati presenti, il che si traduce in KH (durezza temporanea). Si formerà leggermente calcare e questa è una buona cosa, come da una delle risposte sopra, questo crea un buon ciclo in cui sulla caldaia si forma un sottile strato di calcare protettivo che scambia continuamente con la nuova acqua remineralizzata che viene aggiunta come l'acqua bolle e si raffredda.
Il mio obiettivo è creare un'acqua che abbia un sapore eccezionale ma che sia anche sicura da usare in una macchina per caffè espresso, quindi posso usare le ricette a questo URL in sicurezza? https://www.baristahustle.com/app-archive-main/the-water-calculator/
Ciao Samizzle. Il fatto è che, se crei un'acqua per il caffè utilizzando acqua distillata che non contiene calcio, anche dopo aver aggiunto i sali di Epsom e il bicarbonato tramite i concentrati che consigliamo qui https://www.baristahustle.com/blog/diy-water-recipes-redux/, è possibile che quest'acqua non formi ancora calcare e possa anche arrugginire parti della caldaia o altri componenti. Ecco perché abbiamo creato il calcolatore per bottiglie, per permetterti di rimineralizzare un'acqua che contiene una quantità nota di calcio. Di course devi stare attento a non ritrovarti con un'acqua che forma eccessivamente calcare, quindi anche se trovi una buona acqua base che potrebbe contenere 30 milligrammi / L di calcio secondo l'etichetta sulla bottiglia, assicurati per testare anche il suo GH.
Interessante, sto scoprendo che proprio quando pensavo di averlo capito, non capisco proprio niente :S. Sto ancora cercando di capire la differenza tra magnesio e calcio in relazione alla produzione di calcare, data questa affermazione: "Poiché calcio e magnesio hanno entrambi due cariche positive, si comportano in modo molto simile, quindi possono essere considerati intercambiabili quando parliamo di durezza.
Stai dicendo che il carbonato di calcio deposita il calcare più facilmente del carbonato di magnesio? In tal caso, è possibile suggerire quale quantità di calcio potrei aggiungere al mio concentrato di durezza da 1 litro (oltre ai 2,45 g di sali di Epsom che ho già aggiunto) per bilanciarlo correttamente ed evitare la corrosione?
È corretto. Il magnesio può formare una sorta di incrostazione, ma non tende ad attaccarsi alle superfici come il calcare (il calcare è calcio per definizione).
Il potenziale di formazione di calcare della tua acqua (misurato da LSI) non dipende solo dalla quantità di Ca: dipende anche da cos'altro è presente, dal pH dell'acqua e persino dalla temperatura. Quindi non posso darti una raccomandazione specifica, ma ti incoraggio a controllare l'LSI della tua acqua con il ns Calcolatore dell'acqua.
Detto questo, se la corrosione sia o meno un rischio serio per la vostra macchina dipende da cosa è fatta e da come è costruita. Molte macchine funzionano con acqua distillata senza problemi per molti anni, altre potrebbero notare corrosione anche con acqua naturale. Per ulteriori informazioni su questo argomento, dai un'occhiata nell'AMA abbiamo fatto tutto sull'acqua.
Ottima informazione, grazie. Ho un'altra domanda per te. La nostra acqua è relativamente dura a 350-400 ppm. Stiamo selezionando un addolcitore d'acqua per estrarre gli ioni minerali o un condizionatore d'acqua TAC per forzare la cristallizzazione degli ioni ma non li rimuove. In che modo la presenza di questi cristalli inerti influenzerebbe l'infuso?
Ciao Dan, grazie per il commento. Non abbiamo esperienza diretta con TAC o relative opzioni di trattamento dell'acqua (come condizionatori d'acqua magnetici o elettrici), ma siamo scettici.
Il modo in cui si dice che questo tipo di condizionatore d'acqua funzioni è quello di forzare la formazione di microcristalli di carbonato di calcio, in altre parole, minuscoli cristalli di calcare. La teoria è che formando cristalli nell'acqua, impedisci invece che si formino sulla superficie metallica del tuo scaldabagno.
È possibile che la TAC possa aiutare a ridurre la formazione di calcare in tal modo in determinate situazioni, ma quanto bene funzioni nella maggior parte delle impostazioni del mondo reale è tutt'altro che provato. Questa pagina ha una buona panoramica di ciò che poco si sa su di loro e indica un grave difetto: i cristalli si formano solo se l'acqua è supersatura, quindi mentre può funzionare fino a un certo punto, potrebbe non essere efficace come un ammorbidente per ottenere ai livelli di durezza che ci piacciono per il caffè.
Come citano: "Non può fare nulla per impedire la deposizione di incrostazioni su superfici a temperatura più elevata dove i carbonati saranno meno solubili, né può rimuovere gli ioni di durezza fino a un livello in cui non formeranno schiuma con il sapone". Sospetto che se l'acqua è ancora abbastanza dura da formare una schiuma di sapone, è abbastanza dura da avere un effetto negativo sul caffè. Vale anche la pena ricordare che quei cristalli non sono 'inerti': sono semplicemente piccoli cristalli di calcare e non c'è nulla che impedisca che si ridisciolgano nell'acqua.
Se tu, o uno qualsiasi dei nostri lettori, provate un balsamo TAC per il loro caffè, ci piacerebbe conoscere la vostra esperienza. Ma per ora, consigliamo di attenersi ad ammorbidenti o unità RO per essere sicuri di buoni risultati.
Trovo sempre l'acqua la parte più sconcertante e complessa del caffè. Domanda: se la maggior parte dell'acqua del rubinetto ha un livello inferiore di HCO- rispetto a Mg+ e Ca+, e quando l'acqua è bollita tutto l'HCO- si "accoppia" con Mg+ e Ca+ (formando calcare), come può essere rimasto dell'HCO- nel acqua per ridurne l'acidità?
ho la tua stessa domanda. in cerca di risposta da BH
Ciao Will, ci sono due cose in gioco qui.
Il primo è che ci vuole tempo prima che il calcare si formi. Se stai facendo bollire un bollitore per il caffè, si formerà solo una piccola quantità di calcare quando prepari il caffè, quindi ci sarà ancora molto bicarbonato nell'acqua dopo l'ebollizione. Dovrai far bollire a lungo il bollitore per eliminare tutto il calcare.
Ora, in una macchina per caffè espresso hai effettivamente un bollitore che bolle a lungo - per sempre, se non lo spegni. Ma in questo caso entra in gioco il secondo fattore: anche il calcare presente nella caldaia inizia a dissolversi nell'acqua. C'è un punto di equilibrio in cui la quantità di calcare che si dissolve è la stessa della quantità che si forma: questa è l'idea alla base dell'indice di saturazione di Langelier, di cui puoi leggere di più in Il corso d'acqua.
Ah grazie, questo ha molto senso. Quindi, tenendo l'acqua ad alta temperatura in un recipiente "pulito" per lungo tempo, potresti eliminare più bicarbonato, ma la filtrazione diventa ovviamente un'opzione più sensata.
Hey! Sono stato a lungo perplesso da una semplice domanda: se le forme di Mg si ridimensionano altrettanto bene di Ca, perché Hendon e M CD sostengono di sostituire Ca per Mg? Oppure Mg è in qualche modo “più sicuro” in termini di scaling (dato che 95% delle sorgenti avvisa solo di Ca, sembra proprio di sì…)?
Ciao, grazie per aver postato questo - è una buona domanda.
La risposta breve è che pensano che migliori il sapore. Propongono che il Mg estrae proporzionalmente più composti aromatici desiderabili. Questo si basa sui loro stessi test del gusto e suggeriscono un meccanismo per farlo tramite la chimica computazionale (https://pubs.acs.org/doi/pdf/10.1021/jf501687c) ma per quanto ne so questo non è stato confermato in modo indipendente.
Il motivo principale per cui la maggior parte delle fonti avvertono del ridimensionamento del calcio è che il calcio è solitamente il componente principale della durezza nell'acqua potabile, quindi il ridimensionamento del magnesio non è un grosso problema. Tuttavia, la sostituzione del calcio con il magnesio può anche ridurre leggermente l'impatto della scala. Il magnesio interferisce con la struttura cristallina delle incrostazioni di carbonato di calcio, rendendo più probabile la formazione di cristalli di aragonite, che sono leggermente più solubili dei cristalli di calcite formati da carbonato di calcio puro. Il magnesio stesso forma scaglie di carbonato di magnesio e idrossido di magnesio, ma entrambi sono un po' più solubili dell'idrossido di calcio a 100°C. Quindi sembra possibile che anche avere una percentuale maggiore di magnesio sia "più sicuro".
Sì, grazie per la risposta, è davvero utile! È qualcosa che non ho ancora incontrato.
“…ma entrambi sono un po' più solubili dell'idrossido di calcio a 100°C” – qui intendi CaCO3, giusto?
Vivo negli Stati Uniti e sembra da quello che posso capire dal rapporto sulla qualità dell'acqua del mio distretto idrico locale che abbiamo acqua molto dura. Quindi uso l'acqua in bottiglia per fare il caffè. Mi sono imbattuto nella brocca d'acqua di punta. Mi chiedevo se tutti voi avete avuto la possibilità di dare un'occhiata.
Ciao Timoteo. Il filtro Peak Water recensisce davvero bene. Scott Rao lo raccomandava caldamente nella sua recente newsletter di dicembre. Un commento che abbiamo sentito alcune volte è che è meno coerente nel tempo, ma questo è previsto con tutti i sistemi a scambio ionico.
Ho confrontato Peak con la caraffa filtrante Brita Marella (usando cartucce Maxtra). Sono entrambi quasi ugualmente efficienti in termini di scambio ionico (la cartuccia Brita era un po' usata, quindi ho fatto uno sconto per questo), ma TBH Brita si sente molto più solido in termini di materiali e design. Peak ha questa sensazione di plastica prodotta in Cina di bassa qualità, sfortunatamente, e temo che non durerà a lungo.